ヘバーデン結節、手の変形性関節症は、手の軟骨がすり減る物理的な刺激だけのイメージを持たれる方の多い病気ですが、内部には炎症性サイトカインの関与があり、これが将来の治療方法につながると考えられます。
炎症性サイトカインの関与
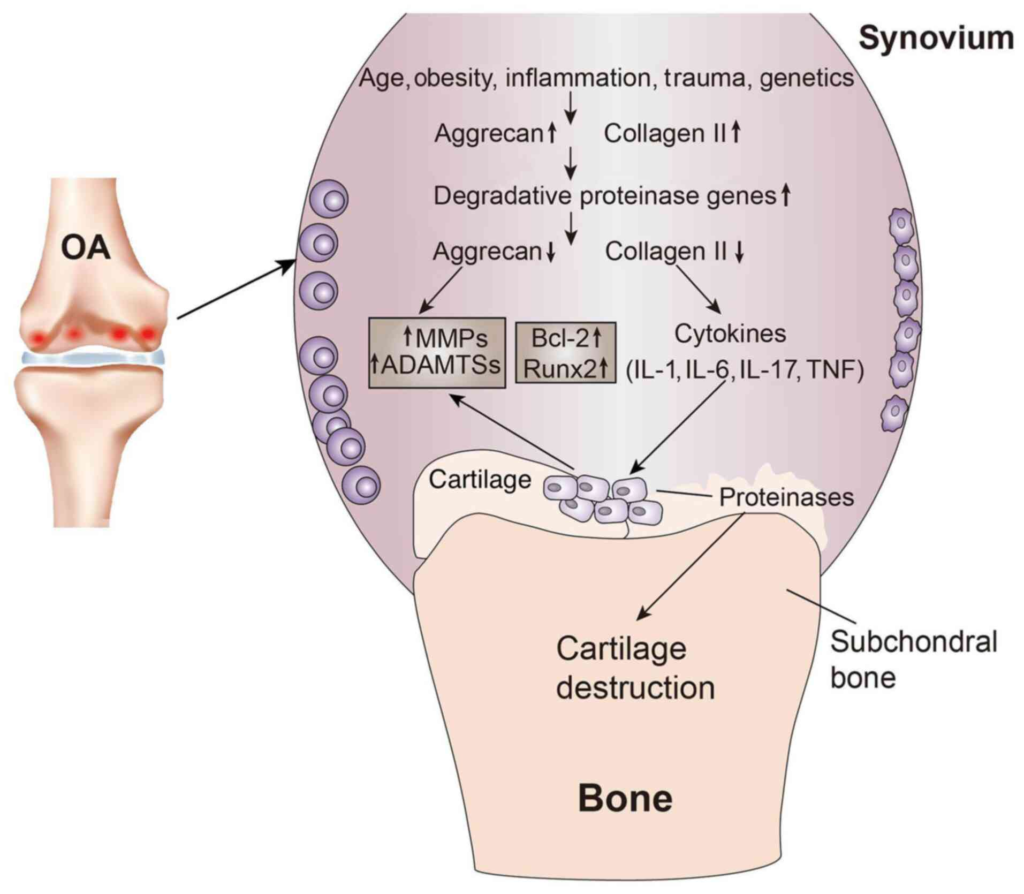
炎症性サイトカインとは、体の中で炎症を引き起こす物質(情報伝達タンパク質)のことです。簡単に言うと、ケガや関節のダメージがあるときに細胞から出てくる「炎症のメッセンジャー」のようなものです。この物質が関節に増えると、痛みや腫れ(炎症反応)を強める作用があります。ヘバーデン結節のように関節の軟骨がすり減って傷つくと、関節内でこの炎症性サイトカイン(例えば インターロイキン1(IL-1)やTNF-αなど)が放出されます。すると関節の中で炎症が起こりやすくなり、腫れや痛みが出てきます。そして炎症性サイトカインは軟骨をさらに分解する酵素を呼び寄せたり、骨を溶かす細胞を刺激したりして、軟骨の破壊を進めてしまうこともあります。
つまり、炎症性サイトカインは関節のダメージを悪化させる「悪循環」の一因となっているのです。
IL-1βおよびTNF-α: ヘバーデン結節では、IL-1βやTNF-αといった炎症性サイトカインが関節内で増加し、軟骨の分解と滑膜の炎症を促進します。IL-1βとTNF-αは軟骨細胞のNF-κB経路やMAPK経路を活性化し、マトリックスメタロプロテアーゼ(MMP)やADAMTS(プロテオグリカン分解酵素)の発現を誘導して軟骨基質の崩壊をもたらします。同時に一酸化窒素合成酵素(iNOS)やシクロオキシゲナーゼ2(COX-2)、プロスタグランジンE2合成酵素の発現も誘導され、軟骨細胞のアポトーシスやさらなる炎症を惹起します。
IL-1βは滑膜細胞や軟骨細胞自身からIL-6やLIFなど他のサイトカイン産生も誘導し、ポジティブフィードバックによって自身の作用を増幅します。実際、変形性関節症患者さんの滑膜には正常関節より高濃度のIL-1βやTNF-αが検出されており、これらのサイトカインが滑膜マクロファージや線維芽細胞様滑膜細胞を刺激して炎症性メディエーター(IL-8やCCL5〔RANTES〕、VEGFなど)の放出を促すことで関節全体の炎症環境が形成されることがわかってきました。
またTNF-αとIL-1βは協調してNF-κBを活性化し、軟骨細胞の分解酵素や炎症性因子の発現を強力に促進します。NF-κB経路はOA病態の中核であり、この経路を阻害するとIL-1β誘導性の分解酵素産生が低減し、動物モデルでは軟骨破壊の進行抑制効果が認められています。
IL-6: IL-6もOA関節における重要なサイトカインで、滑膜細胞や軟骨細胞がIL-1βやTNF-α刺激に応答して産生する。IL-6はgp130受容体サブユニットを介して細胞内にシグナルを伝達し、ヤヌスキナーゼ/シグナル伝達・転写活性化因子(JAK-STAT)経路を活性化する。これにより軟骨細胞での遺伝子発現や破骨細胞分化因子の産生が変化し、関節破壊に寄与すると考えられる。例えばIL-6はNF-κB経路の標的遺伝子でもあり、IL-1β刺激下で誘導されて炎症と軟骨分解を増幅します。さらにIL-6は滑膜炎や軟骨破壊の程度と相関し、IL-6遺伝子多型により手指OA(ヘバーデン結節)の発症リスクが変化することも報告されています。
例えば肥満患者では脂肪組織由来のIL-6が高く、これがヘバーデン結節を含む変形性関節症リスク上昇の一因になると考えられています。IL-6は関節局所のみならず全身性炎症とも関連し、JAK-STAT3経路を通じた軟骨破壊促進と急性期応答の媒介という二面的な役割を持ります。
IL-17: IL-17(主にIL-17A)はTh17細胞などから産生される炎症性サイトカインで、変形性関節症の進行において近年重要性が認識されている。IL-17自体は関節液中での濃度上昇が全てのOA患者で見られるわけではないが、炎症性OAのサブセットではIL-17が関与しうるという報告もあります。IL-17はTNF-αとの相乗効果によりIL-1β、IL-6、IL-8など多数の炎症メディエーター産生を増強し、急性の炎症反応を慢性化・増幅させます。
軟骨細胞および滑膜線維芽細胞に対しては、補体や低酸素応答、血管新生、エネルギー代謝関連の遺伝子発現を変化させ、関節の恒常性を乱します。実際、膝OA患者の関節液中IL-17濃度は軟骨欠損や骨髄病変の重症度と正の相関を示し、ウサギ膝関節にIL-17を注入すると軟骨変性と骨増殖を伴うOA様の変化が誘導されたとの報告もあります。
IL-17は滑膜や軟骨細胞からRANKL(受容体 activator of NF-κB ligand)の発現を増強する作用も持ち、JAK2/STAT3経路の関与を通じて骨吸収を促進することが示唆されており、このようにIL-17はNF-κB経路の活性化や他サイトカイン誘導を介して軟骨・滑膜に炎症と破壊的変化をもたらす一方、骨のリモデリングにも影響を及ぼしうると考えられています。
シグナル伝達経路の総括: 以上のサイトカインはいずれもNF-κBを中核とした炎症性経路に収斂し、軟骨細胞の分解酵素産生・アポトーシス誘導、滑膜炎症の増幅を招く
NF-κB経路は関節軟骨の恒常性破綻に直結するため、その過剰な活性化はヘバーデン結節を含むOAの進行因子と考えられます。またJAK-STAT経路は主にIL-6やIL-15などサイトカイン受容体共通サブユニットgp130経由のシグナルで活性化し、炎症遺伝子発現や軟骨細胞の形質転換に寄与する。例えばSTAT3は炎症環境下で軟骨細胞の肥大化や軟骨基質産生低下にも関与する可能性が報告されている
まとめると、これらシグナル経路の協調的活性化が関節内の炎症性悪循環を形成し、軟骨・滑膜・骨の病的変化を推進していると考えられます。実際、軟骨基質の分解産物(例えば断片化したアグリカンやコラーゲン)はToll様受容体(TLR)や補体系を活性化し、滑膜細胞からサイトカインやケモカインの産生を誘導することで炎症を惹起し、こうした無菌性炎症が慢性的に続くことが、DIP関節を含むOA病変の進行と疼痛に大きく寄与しているとされます。
骨リモデリングの詳細とDIP関節の特徴
Wnt/β-カテニン経路: Wnt/β-カテニン経路は骨・軟骨の分化と恒常性維持に重要な経路である。変形性関節症ではWntシグナルの過剰活性化が見られ、軟骨や滑膜で発現亢進が報告されています。モデル動物では、β-カテニンの増加が機械的ストレス負荷OAやIL-1β刺激下の軟骨で観察されており、過剰なWntシグナルは軟骨細胞にMMP-13やADAMTS4/5といった分解酵素を過剰発現させることで軟骨を破壊し、同時にWntシグナルは軟骨細胞を線維芽細胞様に脱分化させ(I型コラーゲン産生の増加など)、正常なII型コラーゲン産生能を低下させることも示されています。
一方、亢進したWntシグナルは骨代謝にも影響し、特にDIP関節周囲で顕著な骨棘(ヘバーデン結節)形成を誘導する。Wnt経路の一部である非古典経路(Wnt-5a系)は軟骨分解や滑膜炎症だけでなく、骨の破骨・骨形成バランスの破綻を招き、骨硬化症様の変化をもたらすことが知られています。実際、変形性関節症では関節辺縁で骨棘形成と軟骨下骨硬化(骨密度・骨量の増加)が生じるが、これはWntシグナル過剰による骨芽細胞活性化が関与していると考えられます。
Wnt経路を抑制することで軟骨細胞の分化を正常化しつつ骨棘形成を減少させる試みもなされており、Wnt阻害剤の投与で軟骨細胞増殖とII型コラーゲン産生が促進され、骨棘が減少したとの報告があります。実際、ロレシビバント(Lorecivivint)はWnt/β-カテニン経路を阻害する低分子化合物で、OAの治療薬(疾患修飾薬)として臨床試験が行われていたりします。(初期研究では十分な構造改善効果は示せなかったものの、Wnt経路は骨リモデリングと軟骨保護の両面から有望な標的と考えられています)
ただしWntは完全に阻害しすぎても軟骨に有害であり、生理的な適度のWnt活性が軟骨・骨の恒常性に必要である点も指摘されているます。
TGF-β経路: トランスフォーミング増殖因子β(TGF-β)は軟骨・骨代謝の調節因子で、正常関節では軟骨マトリックス維持に役立っている。TGF-βは軟骨細胞増殖やプロテオグリカン産生を刺激するため、適切なレベルでは軟骨保護的に働く
しかしOAでは関節ごとのTGF-βシグナルのバランス異常が生じる。特に軟骨下骨でのTGF-β1の過剰活性化は病的リモデリングを誘発することが明らかになっている。関節不安定モデルマウスでは、過負荷に応答して軟骨下骨中の活性型TGF-β1濃度が上昇し、これが間葉系幹細胞(MSC)の集積と異常な骨新生(骨硬化や骨棘形成)、血管新生を促進します。
実際、骨芽細胞で活性型TGF-β1を過剰発現させた遺伝子改変マウスは自発的にOA様変化(軟骨下骨の肥厚・血管増生と軟骨変性)を呈した一方で、軟骨下骨におけるTGF-βシグナルを阻害すると、異常な骨硬化や血管侵入が抑制され軟骨変性も軽減することが示されています
例えばTGF-βのシグナル伝達受容体であるALK5(TβRII)を骨内MSCで欠損させたマウスでは、OA誘発モデルにおいて軟骨変性が有意に減少しました。
これらの結果から、軟骨下骨での高濃度TGF-β1はOA病変を開始・促進する引き金となり得ることが示唆されます。しかしTGF-βの作用は二面的であり、内因性TGF-βを過度に抑制すると骨棘形成は抑えられる反面、軟骨マトリックスの維持が損なわれ軟骨変性が進行するという報告もあります。実際、TGF-β1欠損マウスや軟骨細胞でのTGF-βシグナル遮断は軟骨プロテオグリカンの消失と変性を招きます。
変経営関節症患者さんの軟骨ではALK5-Smad2/3経路に対してALK1-Smad1/5経路が相対的に亢進し、異常な軟骨肥大化と変性に繋がるというメカニズムも提唱されている
総じて、TGF-β経路の異常制御が軟骨下骨のリモデリングと軟骨変性を結びつける重要な因子と考えられる。特にヘバーデン結節形成では、骨端部でのTGF-βを介した骨棘形成シグナルと軟骨変性の進行が同時並行的に起こっている可能性が高い。
骨リモデリングと炎症の相互作用: OAでは炎症と骨リモデリングが密接に関連し、破骨細胞と骨芽細胞の動的バランス破綻が特徴的である。炎症性サイトカイン(IL-1β、TNF-α、IL-17など)は骨芽細胞や滑膜細胞に働きかけてRANKLの発現を誘導し、破骨細胞の分化・活性化を高める。破骨細胞による骨吸収が進むと、骨基質中に埋蔵されていたTGF-βやIGF-1などの増殖因子が活性化され、これが周囲のMSCを遊走・分化させて新たな骨形成(骨硬化や骨棘)を促すというサイクルが生じる
実際、「骨吸収→成長因子放出→過剰な骨新生」というリモデリングサイクルが関節不安定モデルで観察されており、これを阻害することで軟骨の保護につながることが示唆されている。また軟骨下骨の血管侵入と骨髄の線維化(いわゆる骨髄病変)はOA進行部位で顕著であり、炎症メディエーターがこうした血管新生や骨髄環境変化も引き起こす
結果として、骨のリモデリングは局所の力学的ストレスだけでなく慢性炎症刺激によっても駆動され、骨密度の異常上昇域(硬化や骨棘)と低下域(嚢胞や侵食)が混在するOA特有の骨病変が形成される。特にヘバーデン結節では、DIP関節辺縁の骨膜下で骨芽細胞の活性化(WntやTGF-βシグナル)と炎症(IL-1βやTNF-αによるNF-κB活性化)が同時に進行し、小さな関節ながら顕著な骨増殖性の結節として触知される変化をきたす。興味深いことに、初期のヘバーデン結節形成はX線では検出困難な靭帯付着部の微小な炎症と骨反応から始まる可能性が指摘されている。DIP関節の側副靭帯付着部に生じる線維軟骨の変性や骨反応が、やがて明瞭な骨棘へと進展するとの病態仮説であり、OAを「靭帯病(エンテソパチー)」の側面から捉え直す見解もある。
このようにDIP関節は他の大関節OAと比べて関節包靭帯の付着部位での骨増殖が顕著で、炎症が関節周囲(periarticular)に広がる傾向がある点で特徴的である。また手指OAは遺伝的素因が強いことも知られ、IL-1遺伝子クラスターの多型がヘバーデン結節を伴う手OAの感受性に関連するとの報告もある
したがって、ヘバーデン結節の骨リモデリングには全身的要因(遺伝素因やホルモン変化)と局所要因(力学的ストレスと炎症性サイトカイン)が複合的に関与し、WntやTGF-βを介した骨新生シグナルとNF-κBを介した炎症シグナルの相互作用がその発生母地となっている。
分子メカニズムを標的とした治療法の応用可能性
抗サイトカイン療法: ヘバーデン結節を含むOAに対し、リウマチなどで有効な抗サイトカイン生物学的製剤の応用が試みられている。IL-1βを阻害するアナキンラ(IL-1受容体拮抗薬)やTNF-α阻害薬(エタネルセプト、アダリムマブ等)が臨床研究で検討されたが、単独関節への投与では疼痛や炎症に対する有効性は限定的であった。例えば膝OA患者に対するアナキンラの関節内投与試験ではプラセボと比較して有意な症状改善が得られず、TNF阻害薬アダリムマブを用いた侵食性手指OA(ヘバーデン結節を含む)へのランダム化比較試験でも、疼痛や骨髄病変、滑膜炎に対する有効性が確認できなかった
IL-6阻害(トシリズマブ)やIL-17阻害(セクキヌマブ等)は、炎症性OAへの潜在的効果が期待されるものの、現在までに確立したエビデンスはなく今後の研究課題である。一方、サイトカイン経路を間接的に抑制する低分子薬も検討されている。NF-κB経路の上流で作用するIKK阻害剤や、炎症性経路に関与するp38 MAPK阻害剤は軟骨破壊抑制の可能性が示唆されたものの副作用の懸念があり開発が難航している
近年、JAK-STAT経路を阻害するJAK阻害薬(トファシチニブ等)も関節リウマチで実用化されており、同経路が関与するIL-6やIL-17シグナルの抑制を通じてOA炎症を緩和できる可能性が議論されている。
骨リモデリング分子の標的化: 骨の過剰リモデリングと軟骨変性を抑制することを狙いとした治療も研究されている。上述のWnt/β-カテニン経路に対する抑制はその一つで、前述したロレシビバントは軟骨保護効果と骨棘形成抑制を目指した薬剤である
臨床第II相試験ではX線上の顕著な構造改善には至らなかったが、軟骨変性の進行抑制や疼痛軽減の可能性が示唆されている
また軟骨下骨で過剰なTGF-β活性を抑えるアプローチとして、ハロフジノン(TGF-β阻害作用を持つ誘導体)の動物モデル投与が検討され、異常な血管新生と骨硬化を抑制してOA進行を緩和する結果が報告されている
破骨細胞による骨破壊が顕著なケースでは、デノスマブ(抗RANKL抗体)による破骨細胞抑制が骨病変を是正しうる可能性もあるが、OAでは骨破壊より骨増殖が目立つため適応は限定的である。逆に骨硬化が強く痛みを伴うような場合には、ビスホスホネート系薬剤による骨リモデリング抑制が疼痛軽減に寄与し得るとの報告もあり、骨代謝を標的に含めた治療の最適化が模索されている。
再生医療と遺伝子治療: 炎症と変性が進行した関節に対し、再生医療的アプローチも試みられている。自家培養軟骨や軟骨細胞シートの移植は主に膝OAで研究されているが、手指DIP関節のような小関節にも応用可能な技術が模索中である。また近年は**間葉系幹細胞(MSC)**を関節内に投与して損傷組織の修復と炎症制御を図る治療が注目されている。MSCは抗炎症性サイトカイン(IL-10やTGF-β3など)や成長因子を分泌し、滑膜炎の沈静化や軟骨細胞のアナボリック作用を促進する可能性がある。実際、変形性関節症に対する種々の細胞治療(組織移植、細胞濃縮物、培養幹細胞など)の臨床試験が行われており、一部では疼痛や可動域の改善が報告されている
しかし再生医療は効果のばらつきや安全性、コストの問題もあり、確立した治療法となるには更なる検証が必要である。
同時に、遺伝子治療やRNA干渉技術を用いた先端的治療も研究段階にある。例えば、関節内に特定遺伝子のsiRNAを送達して病態分子をサイレンシングする試みでは、動物モデルにおいてNF-κB p65の発現を抑制するsiRNAを関節注射することで外傷誘発OAの軟骨病変を軽減することに成功している
このような標的遺伝子サイレンシングや、逆に軟骨保護因子を発現させる遺伝子導入(例えばIL-1受容体拮抗や軟骨成長因子の遺伝子)によって関節内部から分子レベルで病態を是正する戦略が追究されている
近年のレビューでは、siRNAによる遺伝子サイレンシング、miRNAやアンチセンスRNAによる多遺伝子調節、mRNAやCRISPR-Cas9による遺伝子補充・編集など、様々なRNAベースの技術が将来のOA治療に応用可能であるとまとめられている
さらに、工学的に改変した細胞を関節内に移植し、必要に応じてインシチューで治療分子を放出させるコンセプトも提唱されている
例えば、炎症下で自動的に抗炎症サイトカインを産生するよう遺伝子改変した軟骨細胞やMSCを用いれば、関節内環境に応答した持続的な治療効果が期待できる。これら遺伝子・細胞工学的アプローチはまだ研究段階だが、変形性関節症の基礎病態(サイトカインネットワークやシグナル伝達)そのものを修飾できる画期的治療として期待が寄せられている
現在の臨床応用と展望: 現時点でOAに対する疾患修飾療法は確立しておらず、痛みの緩和や関節機能の維持を目的とした保存療法(NSAIDsやヒアルロン酸注射など)が中心である
しかし上述のような分子標的治療の知見を踏まえ、いくつかの新規療法が臨床試験段階にある。例えば、FGF-18製剤(スプラフェルミン)による軟骨再生誘導、抗NGF抗体(タネズマブなど)による疼痛伝達阻害、複合抗酸化剤やタイトジャンクション阻害剤による炎症反応抑制などが試みられている。また富血小板血漿(PRP)の関節内注射は変形性関節症の痛みと機能改善に一定の効果を示し始めており、その作用機序としてPRP中の成長因子がIL-1やWntシグナルを調節して軟骨・骨の恒常性を改善することが示唆されている
実際、PRP投与により炎症性サイトカイン産生が減少し軟骨細胞の分化形質が改善するという報告もある。ヘバーデン結節を含む手指OAに対しても、局所のステロイドやヒアルロン酸注射に加えてPRPやMSC投与を行うケースが出始めており、手の小関節特有の有効性について今後明らかにされるだろう。
生活習慣・運動療法との関連: 基礎分子レベルの介入だけでなく、生活習慣の改善や運動療法も炎症・リモデリングに影響を与える重要な要素である。全身性の慢性炎症はメタボリックシンドロームや肥満とも関連しており、食事改善や減量によって脂肪組織から放出されるIL-6やTNF-αが減少すれば、手指を含むOAの進行リスクを低減できる可能性がある
実際、肥満患者では減量により手のOA症状が軽快したとの報告もあり、全身性炎症負荷の軽減が関節局所の炎症環境を和らげると考えられる。また適度な運動は軟骨の栄養供給や可動域の維持に有益であるだけでなく、抗炎症サイトカイン(IL-10など)の産生を誘導することで関節内環境を改善し得る。ある研究では、変形性膝関節症患者が運動療法を行った後に関節液中のIL-10濃度が有意に上昇したことが報告されており、運動が関節内の抗炎症メディエーターを増やす可能性が示唆されている
さらに筋力強化により関節への荷重バランスが改善すれば、過剰な機械的ストレスによる軟骨傷害や骨リモデリング刺激を減らすことができる。ヘバーデン結節の患者に対しても、手指のストレッチや握力トレーニング等で関節可動域・支持力を維持することが推奨されており、炎症性サイトカイン産生を抑える可能性も含めた保存的介入の相乗効果が期待される。
以上のように、ヘバーデン結節を特徴とするDIP関節OAの病態には、炎症性サイトカインが軟骨・滑膜・骨それぞれに対して破壊的な作用を及ぼしつつ、それが骨リモデリングの異常(骨棘形成や硬化)と複雑に絡み合うことが明らかになってきた。NF-κBやWnt、TGF-βといったシグナル経路の詳細な解析により、炎症と骨変化のクロストークが分子レベルで解明されつつあり、これらを狙い撃ちにする新規治療法の開発も進んでいる
。現在は対症療法が中心であるが、将来的には分子標的薬や再生医療によってヘバーデン結節の形成・進行を抑制しうる疾患修飾療法が実現する可能性がある。最新の研究知見を踏まえ、炎症と骨リモデリングの統合的な視点から手指OAにアプローチすることが今後の課題である。
参考文献:
- Scanzello CR, Goldring SR. “The role of synovitis in osteoarthritis pathogenesis.” Bone. 2012.
- Liu-Bryan R, Terkeltaub R. “Emerging regulators of the inflammatory process in osteoarthritis.” Nat Rev Rheumatol. 2015.
- Xu C, et al. “Targeting Wnt/β-catenin signaling for osteoarthritis therapy.” Drug Discov Today. 2019.
- Zhen G, et al. “Inhibition of TGF-β signaling in subchondral bone mesenchymal stem cells attenuates osteoarthritis.” Nat Med. 2013.
- Snelling SJB, et al. “Dickkopf-3 is upregulated in osteoarthritis and has a chondroprotective role.” Osteoarthritis Cartilage. 2016. (など)
動注治療を
豊田市で受けられる

この治療法は、症状の改善だけでなく、痛みを抱えた日常生活を取り戻す希望として、多くの患者様から期待を寄せられています。
愛知県で動注治療を受けられるクリニックはまだ限られていますが、当院はオクノクリニックとライセンス契約を結び、専門的な治療を提供しています。
へバーデン結節治療の新しい選択肢として、ぜひご検討ください。
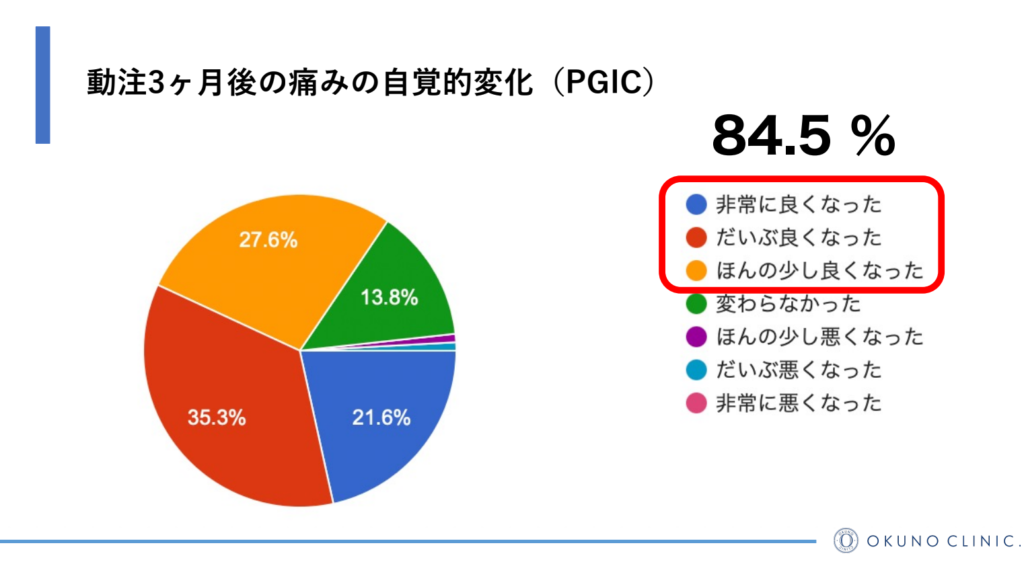
動注治療で 84.5% が改善
オクノクリニックでは、動脈注射療法の効果を追跡するため、定期的に報告会を実施しています。最近のデータでは、治療を受けた方の84.5%が3ヶ月以内に痛みの自覚症状が改善したと報告されています。
この高い改善率は、動脈注射療法がヘバーデン結節の根本的な原因にアプローチし、痛みを効果的に和らげる治療法であることを示しています。
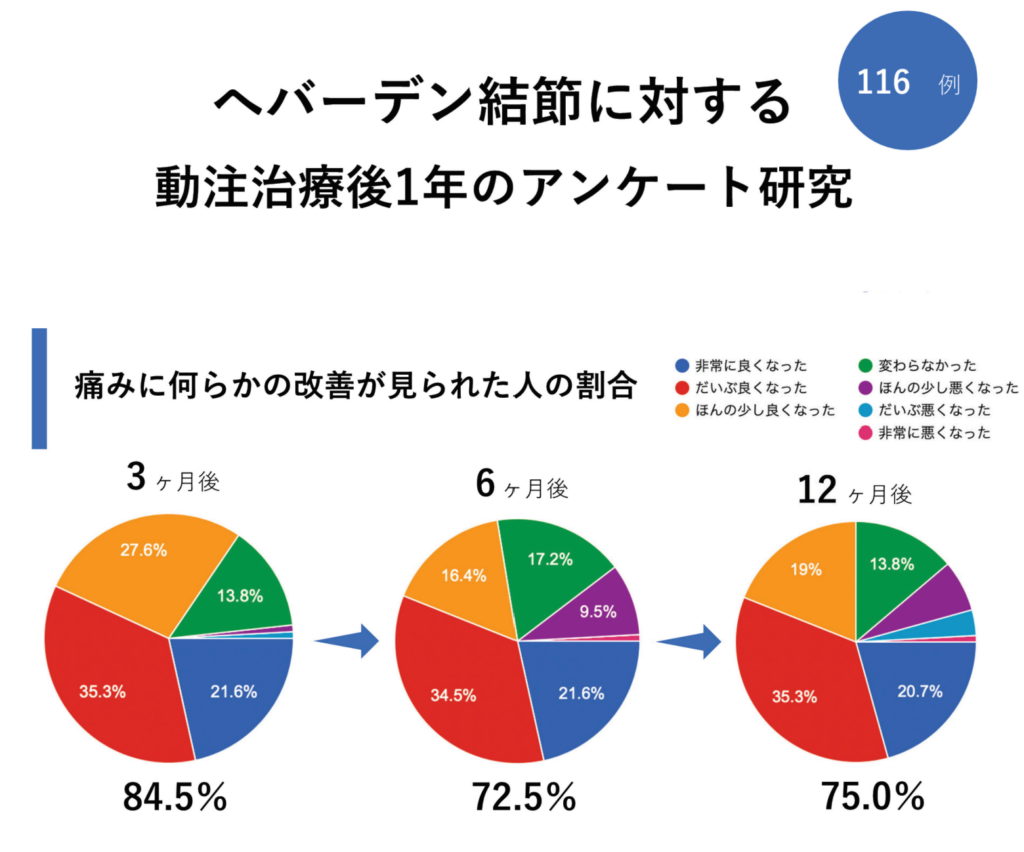
さらに、動注治療後1年間の116例を対象としたアンケート研究では、3ヶ月後に84.5%、6ヶ月後に72.5%、12ヶ月後に75%の方が症状改善を実感しています。この結果は、動注治療が持続的な効果を持つことを裏付けています。
多くの患者様が、この治療によって日常生活の質を取り戻し、新たな希望を見出しています。痛みや不調に悩む方は、ぜひ動注治療を選択肢の一つとしてご検討ください。
痛みの軽減と日常生活の改善を目指し、患者様一人ひとりに合わせた治療を提供しております。
もし「痛みが続いている」「改善が見られない」と感じている方はぜひご相談ください。ご予約はお電話またはウェブで承っております。ご来院心よりお待ちしております。
- 無料LINE相談 指の痛みや変形にお悩みの方へ
ヘバーデン結節を医師に相談したい、と感じたら以下のフォームよりお気軽にご相談ください。
お問い合わせフォームはこちら - 合わせて知っておきたい「ヘバーデン結節」の解説はこちら
ヘバーデン結節治療の最新ガイド(リンク先)
さらに詳しい解説や他の関節疾患についても紹介していますので、ぜひご覧ください。 - 当院で実施しているへバーデン結節への動注治療の解説はこちら
へバーデン結節への動注治療という新しい選択肢
当院で実施している、へバーデン結節への動注治療を解説します。
指の悩みを解決するヒントを見つけてみてください。
